12/02/2023
Determinar si una disolución es endotérmica o exotérmica a partir de una gráfica es fundamental en la comprensión de la termodinámica de las reacciones químicas. Una gráfica adecuada muestra la variación de energía durante el proceso de disolución, permitiendo identificar claramente si el proceso absorbe o libera calor.
Entendiendo los procesos endotérmicos
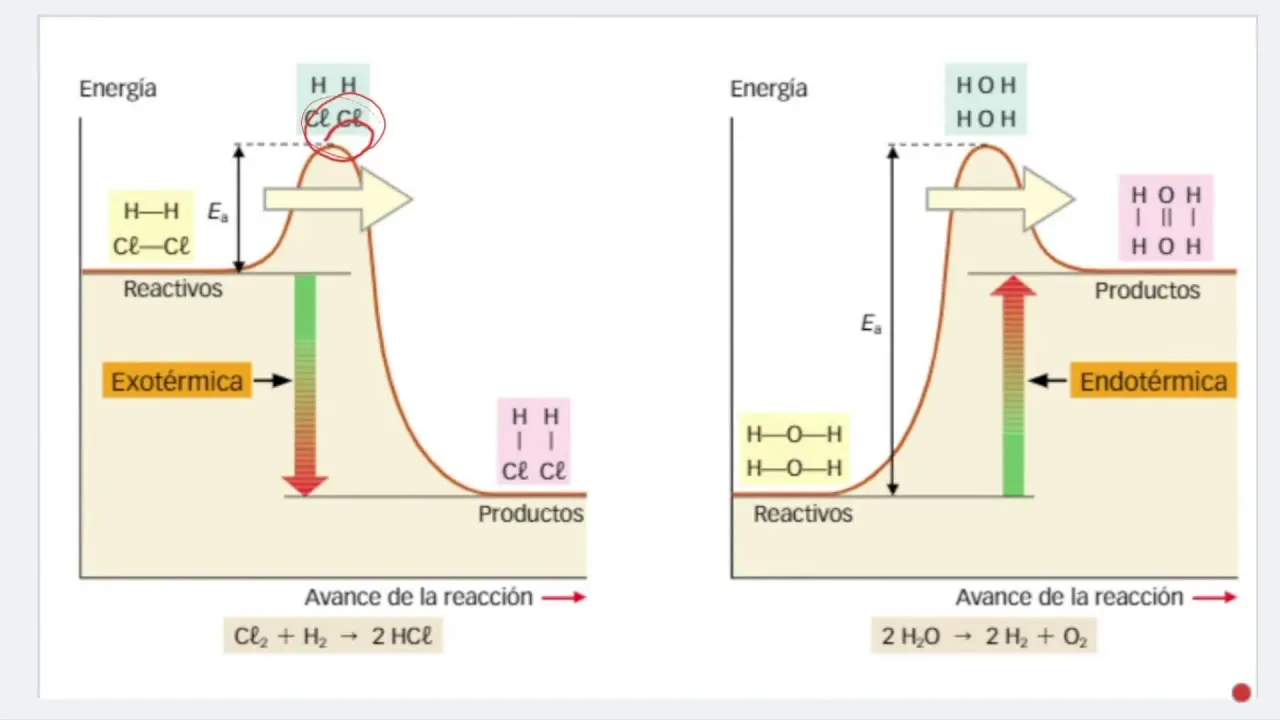
Una reacción endotérmica es aquella que absorbe energía del entorno en forma de calor. En una disolución endotérmica, la energía necesaria para romper los enlaces de los solutos y del solvente es mayor que la energía liberada al formarse nuevos enlaces entre las partículas del soluto y del solvente. Como resultado, la temperatura del sistema disminuye durante el proceso de disolución.
Interpretando gráficas de disoluciones
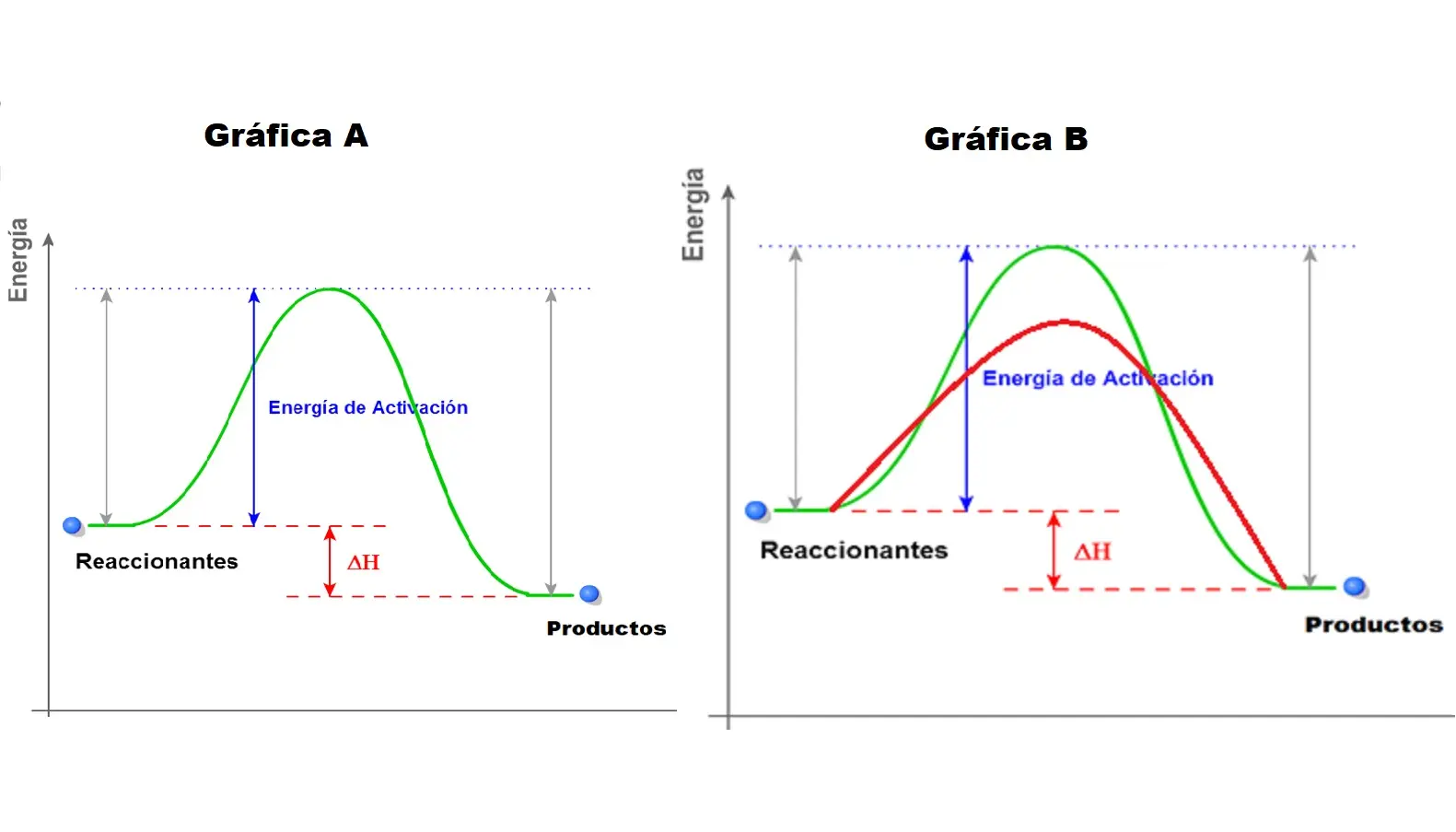
Las gráficas que representan la variación de energía durante una disolución suelen mostrar la energía potencial en función del progreso de la reacción. Para identificar una disolución endotérmica, se debe prestar atención a los siguientes aspectos:
- Energía de los reactivos (soluto + solvente): Se representa el nivel de energía inicial del sistema antes de la disolución.
- Energía de los productos (disolución): Se representa el nivel de energía final del sistema después de que el soluto se ha disuelto completamente.
- Cambio de entalpía (ΔH): Es la diferencia entre la energía de los productos y la energía de los reactivos. Se representa gráficamente como la diferencia de altura entre ambos niveles de energía.
Cómo identificar una disolución endotérmica en una gráfica
En una gráfica que representa una disolución endotérmica, se observará lo siguiente:
- La energía de los productos es mayor que la energía de los reactivos. Esto significa que el sistema ha absorbido energía del entorno para completar la disolución.
- El cambio de entalpía (ΔH) es positivo. Un valor positivo de ΔH indica que la reacción ha absorbido calor del entorno, un rasgo característico de las reacciones endotérmicas.
- La flecha que indica el cambio de energía apunta hacia arriba. Esta flecha visualmente representa la absorción de energía.
Ejemplos de gráficas de disoluciones endotérmicas
Para ilustrar, imaginemos dos gráficas: una representa una disolución endotérmica y la otra una disolución exotérmica. En la gráfica de la disolución endotérmica, la línea de energía de los productos estará situada por encima de la línea de energía de los reactivos. La diferencia vertical entre ambas líneas representa el ΔH positivo. En cambio, en la gráfica de la disolución exotérmica, la línea de energía de los productos estará por debajo de la línea de energía de los reactivos, con un ΔH negativo.
| Característica | Disolución Endotérmica | Disolución Exotérmica |
|---|---|---|
| Energía de los productos | Mayor que la de los reactivos | Menor que la de los reactivos |
| Cambio de entalpía (ΔH) | Positivo | Negativo |
| Dirección de la flecha en la gráfica | Apunta hacia arriba | Apunta hacia abajo |
| Variación de temperatura | Disminución de la temperatura | Aumento de la temperatura |
Consultas habituales sobre disoluciones endotérmicas
Algunas consultas habituales que surgen al analizar gráficas de disoluciones endotérmicas incluyen:

- ¿Cómo se representa gráficamente la energía de activación? La energía de activación se representa como la diferencia de energía entre los reactivos y el punto máximo de la curva de energía. En una disolución endotérmica, este punto máximo de energía estará por encima de la energía de los productos.
- ¿Qué unidades se utilizan para medir el cambio de entalpía? El cambio de entalpía se mide normalmente en julios (J) o kilojulios (kJ) por mol.
- ¿Cómo afecta la concentración del soluto a la gráfica? La concentración del soluto puede afectar la magnitud del cambio de entalpía, pero no altera la naturaleza endotérmica o exotérmica de la disolución.
- ¿Qué otros factores pueden influir en la gráfica? Otros factores como la presión y la temperatura pueden influir en la gráfica, pero la forma general de la curva (ΔH positivo para reacciones endotérmicas) se mantendrá.
Conclusión
Interpretar una gráfica para determinar si una disolución es endotérmica es un proceso relativamente sencillo. Si la energía de los productos es superior a la energía de los reactivos, y el cambio de entalpía (ΔH) es positivo, entonces la disolución es endotérmica. La comprensión de estos conceptos es crucial para la comprensión de la termodinámica y la química en general.
Es importante recordar que la observación visual de la gráfica es solo una parte del análisis. Para una comprensión completa, se debe complementar con cálculos y consideraciones teóricas.