01/06/2018
La ley de Boyle, también conocida como ley de Boyle-Mariotte, es un principio fundamental en la física que describe la relación entre la presión y el volumen de un gas a temperatura constante. Descubierta independientemente por Robert Boyle en 1662 y Edme Mariotte en 1676, esta ley ha sido esencial para comprender el comportamiento de los gases y tiene numerosas aplicaciones en diversos campos.
Historia de la Ley de Boyle
Mucho antes de su formulación como ley, la relación entre presión y volumen de un gas fue observada por Richard Towneley y Henry Power. Robert Boyle, con la ayuda de su asistente Robert Hooke, realizó experimentos utilizando un tubo en forma de J lleno de mercurio y aire. Al variar la cantidad de mercurio, Boyle observó que al aumentar la presión sobre el aire, su volumen disminuía proporcionalmente. Edme Mariotte, de forma independiente, llegó a las mismas conclusiones, añadiendo además la observación de la influencia de la temperatura en el volumen del gas. Esta ley representa uno de los primeros ejemplos de una ley física expresada matemáticamente, marcando un hito en la historia de la ciencia.
Explicación de la Ley de Boyle
La ley de Boyle establece que para una cantidad fija de gas a temperatura constante, el volumen (V) es inversamente proporcional a la presión (P). Esto significa que si la presión aumenta, el volumen disminuye, y viceversa. Matemáticamente, se expresa como:
P V = k
donde 'k' es una constante que depende de la cantidad de gas y su temperatura. Esta ecuación implica que el producto de la presión y el volumen siempre permanece constante a temperatura constante.
Simbología
| Símbolo | Nombre | Unidad |
|---|---|---|
| k | Constante | Pa·m³ |
| P | Presión | Pascales (Pa) |
| V | Volumen | Metros cúbicos (m³) |
| P 1 | Presión inicial | Pa |
| P 2 | Presión final | Pa |
| V 1 | Volumen inicial | m³ |
| V 2 | Volumen final | m³ |
Para dos estados diferentes (1 y 2) del mismo gas a temperatura constante, la ley se puede expresar como:
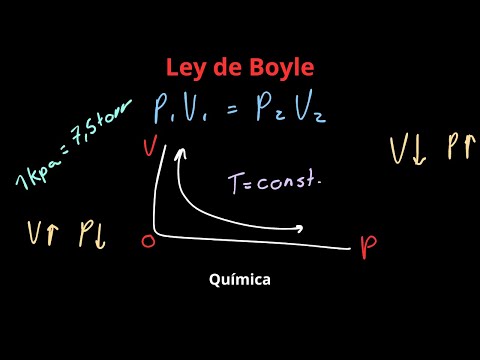
P 1 V 1 = P 2 V 2
Esta ecuación permite calcular el nuevo volumen o la nueva presión si se conoce uno de los valores y se mantiene constante la temperatura. Es una herramienta fundamental para resolver problemas relacionados con el comportamiento de los gases en diversas situaciones.
Gráfica de la Ley de Boyle
La representación gráfica de la ley de Boyle es una hipérbola. Si se representa la presión (P) en el eje Y y el volumen (V) en el eje X, la gráfica resultante muestra una curva que se aproxima a los ejes pero nunca los toca. Cada punto de la curva representa un estado del gas a la misma temperatura (isoterma). Una familia de curvas se obtendría si se realizan experimentos a diferentes temperaturas.
Aplicaciones de la Ley de Boyle
La ley de Boyle tiene un amplio rango de aplicaciones, incluyendo:
- Sistemas de respiración humana: La ley explica cómo los cambios en el volumen de los pulmones causan cambios en la presión del aire, lo que permite la inhalación y la exhalación.
- Buceo: Es crucial para comprender los efectos de la presión del agua en el aire en los pulmones de los buceadores a diferentes profundidades.
- Meteorología: Se utiliza para modelar el comportamiento de la atmósfera y predecir cambios climáticos.
- Ingeniería: Se aplica en el diseño de sistemas neumáticos e hidráulicos.
- Industria química: Es importante en el diseño y operación de procesos químicos que involucran gases.
Limitaciones de la Ley de Boyle
La ley de Boyle es una ley ideal que asume un comportamiento perfecto del gas. En la realidad, los gases reales se desvían de este comportamiento ideal a altas presiones y bajas temperaturas, donde las fuerzas intermoleculares se vuelven significativas. Para un comportamiento más preciso en estas condiciones, se debe utilizar la ecuación de Van der Waals o otras ecuaciones de estado más complejas.
Ejemplos de Aplicación
Imaginemos un globo inflado. Al apretarlo, disminuimos su volumen, aumentando la presión interna del gas en su interior. Al soltarlo, el volumen aumenta y la presión disminuye, volviendo a su forma original (siempre y cuando no se haya roto).
Otro ejemplo es el funcionamiento de un neumático. La presión del aire dentro del neumático se mantiene constante gracias a un volumen definido. Si se produce una fuga, el volumen disminuye y por tanto también la presión.
Consultas Habituales
¿Cuál es la gráfica que representa la ley de Boyle?
La gráfica que representa la ley de Boyle es una hipérbola, mostrando una relación inversamente proporcional entre la presión y el volumen.
¿Qué significa P en la ley de Boyle?
P representa la presión del gas, generalmente medida en Pascales (Pa) u otras unidades de presión.
¿Qué significa k en la ley de Boyle?
k representa una constante de proporcionalidad que depende de la cantidad de gas y la temperatura. Su valor permanece constante para un gas específico a una temperatura determinada.
La ley de Boyle es una ley fundamental en la termodinámica que describe la relación inversa entre la presión y el volumen de un gas a temperatura constante. Su comprensión es esencial en numerosos campos científicos e ingenieriles. Si bien es una ley ideal, proporciona una aproximación útil para comprender el comportamiento de los gases en muchas situaciones prácticas. Para situaciones donde se requieren precisiones mayores, es necesario considerar modelos más complejos, como la ecuación de Van der Waals.

